8.1 Karakteristik Umum dari
Perubahan Keadaan [kembali]
Perubahan
zat pada cairan gas tidak melibatkan perubahan sifat dasar dari molekul-molekul
yang ada. Misalnya, dalam brom padat, molekul Br2 saling bertarikan
dengan agak efektif; dalam keadaan cair, molekul Br2 dengan bebas
bergerak mengikuti molekul yang lain, dan dalam keadaan gas, molekul Br2
berupa partikel yang terpisah jauh satu sama lain, yang melenting kian kemari
dengan kecepatan tinggi dan arah acak. Gambaran ini umumnya dapat diterapkan
kepada zat-zat kovalen.
Pada temperature yang sangat tinggi,
zat padat ion dan logam memang terurai untuk membentuk molekul sederhana,
tetapi ini merupakan keadaan yang sangat tak lazim. Untuk senyawa ion dan
logam, bentuk molekul yang ada dalam keadaan gas tidak terdapat dalam fase-fase
mampat. Misalnya, bila cukup dipanasi agar menjadi gas, natrium klorida
membentuk molekul sederhana seperti Na2Cl2 atau
NaCl. Tetapi dalam zat padat NaCl,
sebuah ion tertarik sama kuat ke semua tetangga terdekatnya yang muatannya berlawanan,
dengan tak terbentuknya struktur-struktur molekul.
Gambar disamping merupakan contoh perubahan
keadaan.
Konsep dasar yang harus diingat:
1. Banyaknya
energy yang dibutuhkan untuk suatu perubahan endoterm sama dengan energy yang
dibebaskan dalam perubahan eksoterm kebalikannya.
2. Energi
total untuk suatu perubahan dari kondisi satu ke kondisi kedua, yang keduanya
tertentu, akan tetap sama, tak peduli jalan yang ditempuh untuk mencapai
perubahan ini.
Titik
leleh dikatakan sebagai temperature dimana suatu zat padat berubah menjadi
suatu cairan, dan titik didih ialah temperature dimana suatu cairan menggelegak
ketika berubah menjadi gas. Pada tekanan yang berlainan, temperature pelelehan
dan pendidihan suatu zat akan berlainan pula. Temperatur untuk perubahan zat
yang bersentuhan dengan udara pada 1 atm dirujuk sebagai titik leleh atau titik
didih normal.
8.1.1 Kapasitas Panas. Bila kalor ditambahkan kepada zat padat,
cairan atau gas pada temperatur di luar titik leleh atau titik didih,maka temperatur
zat itu akan naik.
Untuk
membandingkan efek kalor pada temperatur berbagai zat, maka kapasitas panas zat
itu dapat diukur, yakni banyaknya kalor yang diperlukan zat itu, dengan bobot
tertentu. Makin tinggi bobot suatu zat, akan makin besar kapasitas panasnya. Sedangkan
kapasitas molar adalah banyaknya
kalor yang diperlukan untuk mengubah temperature 1 mol suatu zat setinggi 1°C.
Kapasitas panas molar es adalah
(2,00
J/(g °C)(18,0 g/mol) = 36,0 J/(mol °C)
8.1.2 Kalor Pelelehan Jika 1,00 mol es pada -10,0 °C dipanasi dengan
hati-hati, maka untuk menaikkan temperaturnya menjadi 0 °C, akan dibutuhkan
kalor sebanyak
(1,00
mol)(10.0 °C)[36,0 J/(mol °C)] = 360 J
Kalor pelelehan molar adalah banyaknya kalor yang diperlukan untuk
mengubah 1 mol suatu zat padat pada titik lelehnya menjadi cairan pada
temperature yang sama
Tabel Kalor Pelelehan Molar
Kalor pembekuan molar adalah banyaknya energi panas yang dibebaskan
bila satu mol suatu zat memadat yang besarnya sama dengan banyaknya kalor yang
dibubuhkan bila suatu zat padat meleleh. Misalnya 6,01 kJ dibebaskan ke
sekitarnya bila 1 mol air membeku.
8.1.3 Kalor Penguapan
Bila
1 mol air pada 100°C menguap, 40660 J, atau 40,66 kJ kalor harus ditambahkan
kepada air ini agar berubah menjadi 1 mol kukus. Energi panas sebanyak 40,66 kJ
digunakan untuk melawan gaya-gaya tarik sehingga molekul-molekul air dapat
melepeaskan diri satu dari yang lain sebagai molekul gas. Banyaknya kalor yang
dibutuhkan untuk mengubah 1 mol zat cair menjadi gas pada temperatur yang sama
disebut kalor penguapan molar.
Kalor
pengembunan molar adalah
banyaknya energi panas yang dibebaskan bila satu mol suatu zat mengembun, sama
dengan kalor yang diperlukan bila 1 mol zat (cair) menguap. Misalnya, dibebaskan
40,66 kJ ke sekitarnya, bila 1 mol kukus mengembun pada 100°C.
8.1.4 Perubahan Temperatur dan Perubahan
Keadaan. Berdasarkan teori molekul kinetik, dengan ditambahkan energi kalor
ke suatu zat, energi itu digunakan untuk mengalahkan gaya-gaya tarik yang
mengikat partikel-partikel. Makin tinggi temperaturnya, makin besar energi
kinetik partikel-partikel. Jika perubahan keadaan disertai perubahan volume,
diperlukan energy untuk mendorong udara.
8.1.5 Gaya Tarik dan Perubahan Keadaan. Gaya
tarik yang mempengaruhi pelelehan dan penguapan sangat beragam untuk tiga
kelompok besar zat (kovalen, ion, dan logam). Zat kovalen terdiri dari
molekul-molekul yang berikatan dengan gaya yang agak lemah. Sehingga zat
kovalen cenderung memiliki titik leleh dan titik didih rendah. Sedangkan
ion-ion dalam zat ion dan atom dalam logam biasanya saling berikatan dengan
gaya yang kuat. Senyawa ion cenderung memiliki titik leleh dan titik didih
tinggi.
8.2 Gaya Tarik Antar Molekul [kembali]
Bila
suatu zat kovalen cair menguap, molekul melepaskan diri dari tetangganya. Gaya
tarik lemah antara molekul dikalahkan, tetapi ikatan kovalen yang kuat yang
mengikat atom-atom dalam molekul itu tidak terpatahkan. Dalam gaya tarik antar
molekul ada tiga macam. Dua diantaranya Bersama-sama disebut gaya tarik Van der
Waals. Gaya tarik yang lemah ini disebabkan oleh dipol imbasan sekejap, yang
terjadi antara semua molekul. Gaya tarik Van der Waals yang kuat desebut dengan
gaya tarik dipol-dipol, terjadi antara molekul yang memiliki momen dipol
permanen. Gaya tarik ketiga lebih kuat dari gaya Van der Waals hanya terjadi
antara molekul tertentu dan disebut dengan ikatan hydrogen.
8.2.1 Dipol Imbasan Sekejap
Terdapat
tarikan antara elektron satu molekul dan inti-inti molekul yang lain. Suatu
getaran dalam sebuah molekul mengimbas (menginduksi) suatu geseran dalam
elektron-elektron suatu molekul tetangga. Bila molekul ini berkumpul
bersama-sama seperti dalam keadaan cair, geseran-geseran ini disinkronkan
sehingga terdapat suatu tarikan netto antara banyak molekul bertetangga.
Dipol-dipol imbasan dikatakan bersifat sekejap, karena getaran itu sangat
banyak hingga milyaran dalam satu detik.
Tarikan
lemah yang disebabkan oleh dipol imbasan sekajap, pertama kali diuraikan dalam
tahun 1930-an oleh seorang ahli fisika Jerman Fritz London, sehingga disebut
gaya London. Gaya London menyebabkan adanya tarikan antara molekul-molekul
senyawaan non-polar. Molekul-moekul besar lebih efektif ditarik satu sama lain
daripada molekul-molekul kecil. Zat yang molekulnya bertarikan hanya
berdasarkan gaya London, mempunyai titik didih dan titik leleh yang rendah,
dibandingkan dengan zat lain yang bobot molekulnya kira-kira sama. Jika
moleekul-molekulnya kecil, zat-zat ini biasanya berbentuk gas pada temperature
kamar
8.2.2 Gaya Tarik Dipol-Dipol
Molekul
yang memounyai momen dipol permanen dikatakan sebagai polar. Gaya tarik antara
dua molekul polar disebut gaa tarik dipol-dipol. Tarikan ini lebih kuat
daripada tarikan antara molekul molekul non-polar. Jadi, zat-zat yang terdiri
dari molekul polar cenderung mempunyai titik didih dan titik leleh yang lebih
tinggi daripada molekul non-polar yang kira-kira besarnya sama.
8.2.3 Ikatan Hidrogen
Tarikan
antar molekul yang luar biasa kuatnya, dapat terjadi antara molekul-molekul,
jika satu molekul mempunyai sebuah atom hydrogen yang terikat pada sebuah atom
berelektronegativitas besar, dan molekul tetangganya mempunyai sebuah atom
berelektronegativitas tinggi yang mempunyai sepasang elektrton menyendiri. Inti
hydrogen, yakni proton, ditarik oleh pasangan electron yang berdekatan, dan
berayun bolak-balik antara kedua atom itu. Tarikan antara dua molekul yang
menggunakan bersama-sama sebuah proton disebut ikatan hidrogen. Ikatan hydrogen
memiliki tarikan antar molekul yang sangat kuat. Ikatan hydrogen yang kuat
terbentuk hanya oleh molekul yang mengandung nitrogen(N), oksigen(O), ataupun
flour(F). kelihatannya sepasang electron menyendiri dalam sebuah atom kecil
lebih efektif daripada dalam atom besar, dalam hal ang menarik suatu atom
hydrogen tetangganya.
Dalam
air, ikatan hydrogen sangatlah efektif:
Karena
tiap molekul air berisi dua atom hydrogen dan dua pasangan electron menyendiri,
ikatan hydrogen itu dapat berlanjut dalam tiga dimensi sehingga terbentuk
agregasi-agregasi besar.
8.2.4 Ringkasan gaya tarik
Perbedaan
gaya gaya tarik antara molekul-molekul zat murni dicerminkan oleh titik leleh
dan titik didih zat-zat ini. Pada umumnya, gaya tarik yan kuat dan ukuran
molekul yang besar, keduanya akan menyebabkan titik leleh dan titik didih yang
tinggi.
Dalam
gambar tersebut dialurkan titik leleh dan titik didih untuk lima deret zat.
Dalam dua deret ini, Ne-Xe dan CH4-SnH4 molekul non-polar
saling tarik menarik oleh dipol imbasan sekejap atau gaya London. Dalam kedua
deret untuk membandingkan selisih titik didih dari pasangan molekul yang bobot
molekulnya hamper sama. Perhatikan Ne terhadap CH4, Kr terhadap GeH4, Molekul gas mulia
mempunyai distribusi electron sederhana, tetapi senyawa hydrogen unsur grup IVA
merupakan tetrahedron(bidang-empat) yang saling menarik dengan kuat. Akibatnya
titik didih CH4 dan GeH4, masing masing lebih tinggi daripada Ne dan Kr.
Untuk membandingkan molekul yang strukturnya berlainan tetapi bobot molekul-nya
sama, dalam setiap kelompok titik-titik didih dari ketiga zat polar lebih
tinggi, yang menunjukkan bahwa molekul-molekul ini memerlukan energi kinetic
yang lebih besar untuk memisahkan satu sama lain.
Pada
akhirnya dapat dicatat dalam gambar tersebut perilaku NH3, HF dan H2O. Titik didih (dan
leleh) yang tinggi, dibandingkan dengan PH3, HCl, dan H2S disebabkan oleh
ikatan hydrogen yang kuat antara molekul-molekulnya.
8.2.5 Perilaku fisika lain dari cairan
Tarikan
antar mlekul mempengaruhi banyak sifat cairan selain titik leleh dan titik
didih. Kalor pelelehan dan kalor pengapan merupakan dua sifat semacam itu. Yang
juga dihubungkan dengan tarikan antar molekul adalah tegangan permukaan.
Gaya
antar molekul zat yang sama atau serupa dapat disebut sebagai gaya kohesif.
Gaya gayaantara molekul zat yang berlainan, dan terutama antara cairan atau gas
di satu pihak dan zat padat dipihak lain, disebut gaya adhesive.
Molekul
air ditarik dengan kuat ke gugus-gugus -O-H yang terikat dalam permukaan kaca;
jadi air cenderung merayap ke atas sepandjang dinding dalam wadah. Karena
adanya tarikan antar molekul kohesif, molekul yang merayap ini menarik
molekul-molekul air lain untuk ikut merayap naik. Naiknya sekolom cairan dalam
suatu tabung sempit disebut kenaikan kalpiler. Tinggi kolom bergantung pada
jari-jari tabung, tegangan permukaan cairan, dan bobot kolom.
Merkurium merupakan suatu contoh zat dengan gaya antar
molekul kohesif lebih kuat daripada gaya adhesif ke kaca. Hasilnya ialah bahwa
bila bersentuhan dengan kaca, merkurium cair membentuk meniskus cembung.
8.3 Pencairan Gas [kembali]
Suatu gas dapat diembunkan atau dicairkan oleh
gabungan yang sesuai dari penurunan temperature dan/atau menaikkan tekanan. Bedasarkan
pembahasan skala mutlak, berkurangnya volume suatu gas karena menurunnya
temperatur mengikuti hukum Charles sampai temperatur turun di dekat titik di
mana gas itu mulai mengembun menjadi suatu cairan. Berdasarkan teori kinetik,
jika energy kinetik molekul gas diturunkan dengan menurunkan temperatur
secukupnya, gaya antar molekul akan menjadi efektif dalam mengikat partikel partikel
tekanan. Jika molekul-molekul itu berjauhan, maka gaya tarik akan melemah,
tetapi dengan mendekatnya molekul-molekul itu satu sama lain, maka tarikan itu
akan meningkat. Gas itu mencair jika gaya tarik itu cukup besar.
Tiap
gas terdapat suatu temperatur (temperatur kritis), dimana gas tidak dapat
dicairkan , betapapun besarnya tekanan. Diperlukan tekanan kritis untuk
mencairkan suatu gas pada titik kritis.
Zat-zat
pada tabel diatas dapat dibagi menjadi dua kelas. Empat yang pertama tak dapat
dicairkan pada temperatur kamar, betapapun tingginya tekanan yang diberikan.
Tujuh berikutnya dapat dicairkan pada temperatur kamar hanya dengan menaikkan
tekanan saja.
8.4 Penguapan Cairan [kembali]
Cairan yang mudah menguap terdiri dari
molekul molekul yang mempunyai gaya antar molekul yang lemah; mereka cenderung
tercerai-berai oleh gerakan masing-masing.Seperti ditunjukkan dalam gambar
dibawah (a), beberapa molekul meninggalkan induk cairan (menguap) jika
kebetulan molekul itu berarah ke atas dan cukup kecepatannya untuk mengalahkan
gaya tarik yang lemah itu. Uap adalah nama keadaan gas suatu zat pada suatu
tekanan dan temperatur. Suatu cairan yang mudah menguap disebut atsiri (volatile).
Gambar
(a) Penguapan dari suatu wadah terbuka : lebih banyak molekul yang pergi
daripada yang kembali. (b) Penguapan dalam wadah tertutup : banyaknya molekul
yang meninggalkan cairan per satuan sama dengan yang kembali
8.4.1 Tekanan Uap. Air meninggalkan bejana oleh
penguapan jika bejana itu terbuka. Jika bejana itu tertutup maka tidak ada air
yang meninggalkan bejana karena terjadi peristiwa pengembunan yang
mengakibatkan cairan yang menguap tersebut kembali ke cairan.
Tekanan uap suatu zat didefinisikan
sebagai tekanan yang dilakukan oleh gas zat itu, bila gas itu berada dalam
kesetimbangan dengan fasecair atau padat. Tekanan uap suatu cairan atau padatan
bertambah dengan naiknya temperatur. Gambar 8-11 menunjukkan suatu metoda untuk
menentukan tekanan uap cairan.
Gambar
Penetapan tekanan uap cairan pada 25°C . Bila setetes cairan dimasukkan ke
dalam suatu barometer, tetesan ini akan naik ke ruang hampa diatas kolom
merkurium dan sebagian akan menguap. Ruang di atas kolom merkurium akan segera
jenuh; artinya, terjadi suatu kesetimbangan antara cairan dan fase uap dari
contoh (tetesan) itu. Tekanan uap tersebut memaksa kolom merkurium turun ke
jarak tertentu. Barometer di kiri mempunyai ruang hampa Torricelli di atas
kolom merkurium.
Gambar
8-12. Suatu alur yang
menunjukkan pengaruh temperatur pada tekanan uap dari empat cairan yang lazim.
Temperatur pada mana tekanan uap sebesar 760mmHg, adalah titik didih normal
cairan itu.
Keempat senyawa yang ditunjuk dalam
gambar melukiskan pengaruh ikatan
hidrogen pada tekanan uap. Air, HOH, meskipun bobot molekulnya lebih rendah
daripada etil alkohol,tekanan uapnya lebih rendah daripada semua temperatur
karena efektifnya ikatan hidrogen. Etilena glikol, HOCH2CH2OH, dengan dua gugus
–OH per molekul, membentuk ikatan hidrogen yang lebih efektif daripada etil
alkohol dan agaknya membentuk rantai panjang. Tekanan uap yang tinggi
menunjukkan lemahnya gaya-gaya tarik itu.
Kelembaban relatif. Kadar
kelembaban dalam udara lazim dinyatakan dalam kelembaban relatif. Kelembaban
relatif didefinisikan sebagai penjenuhan persen dari udara degan uap air.
Kelembaban relatif merupakan faktor penting untuk kenyamanan kita. Bila
kelembaban tinggi, maka keringat tidak mudah menguap dan jika kelembaban rendah maka keringat akan
cepat menguap.
Bila udara lembab didinginkan tanpa
kehadiran permukaan padat pada mana uap air mudah mengembun, tekanan parsial
uap air dapat melampaui tekanan uap pada temperatur itu. Udara semacam itu
disebut dengan dilewat-jenubi (supersaturated) dengan uap air.
8.4.2
Pendidihan. Titik
didih suatu cairan ialah temperatur pada mana tekanan uap yang meninggalkan
cairan sama dengan tekanan luar. Bila tekanan uap sama dengan tekanan luar,
mulai terbentuk gelembung gelembung uap dalam cairan. Karena tekanan uap dalam
gelembung sama dengan tekanan udara, maka gelembung itu dapat mendorong diri lewat
permukaan dan bergerak ke fase gas di atas cairan.
Titik didih air dan cairan lain
beraneka ragam menurut tekanan udara. Contoh titik didih normal suatu cairan
ialah temperatur pada mana tekanan uapnya 1 atm. Di pegunungan titik didih air
kurang dari 100°C, karena tekanan udara kurang dari 1 atm.
Contoh
: Jika tekanan udara rata-rata di kota Anda adalah 740 mmHg, berapakah titik
didih air dalam sebuah panel terbuka? Berapakah titik didih air dalam panci
bertekanan yang bekerja pada sekitar dua kali tekanan udara?
Jawaban
: Dari tabel A.7 titik didih air pada 740 mmHg dapat dihitung dengan
interpolasi antara titik didih pada 738,5 mmHg dan 743,9 mmHg
Titik
didih pada 740 mm = 99,2°C + (99,4  99,2) °C
99,2) °C
= 99,2 +
0.06 = 99,3°C
Pada
duakali 740mmHg, dari tabel diketahui bahwa titik didih pada 1480 mmHg  titik didih pada 1489,1 mmHg = 120°C
titik didih pada 1489,1 mmHg = 120°C
8.5 Pembekuan Cairan [kembali]
Titik beku adalah
temperatur pada mana fase padat dan cair ada dalam kesetimbangan. Jika
kesetimbangan semacam itu diganggu dengan menambahkan atau menarik energi panas,
sistem akan berubah dengan membentuk lebih banyak zat cair atau zat padat.
8.5.1 Diagram Fase. Hubungan antara keadaan keadaan suatu zat
padat diringkaskan dalam suatu diagram fase yang menunjukkan fase apa saja yang
ada pada temperatur dan tekanan yang berlainan. Gambar dibawah adalah diagram
fase untuk H2O dalam suatu jangka terbatas temperatur dan tekanan. Pengamatan
berikut dapat dibuat berdasarkan gambar berikut :
Gambar
Suatu diagram fase untuk H2O (diagram ini tidak proporsional)
1. 1. Sepanjang
garis AC,air dan uap air dalam kesetimbangan
2. Perhatikan
titik P yang terletak pada garis AC. Jika tekanan ditambah, misalnya ke Q maka
uap air akan mengembun dan hanya air (cair) saja yang ada. Misalnya tekanan
dikurangi ke R maka semua air akan menguap.
3 3. Sepanjang
garis AB, uap air dan es berada pada kesetimbangan, misalnya pada titik W.
4 4. Garis
AD adalah garis kesetimbangan untuk fase cair dan padat. Garis ini hampir
vertikal,namun kemiringan agak ke kiri agak dibesarkan untuk menjelaskan bahwa
temperatur titik leleh normal air, 0°C, tidak identik dengan temperatur titik A
5 5. Titik
A disebut titik gandatiga (triple), suatu kondisi tekanan dan temperatur
pada mana ketiga fase dalam kesetimbangan.
Titik
Gandatiga Air. Keanekaan
tekanan udara hanya sedikit sekali pengaruhnya terhadap titik beku air maupun
larutan air, baik karena perubahan kelarutan udara dalam air maupun karena
pengaruh tekanan pada suatu perubahan keadaan. Karena air memuai bila beku,
maka bertambahnya tekanan cenderung menghindarkan pembekuan, artinya titik beku
menurun dengan bertambahnya tekanan.
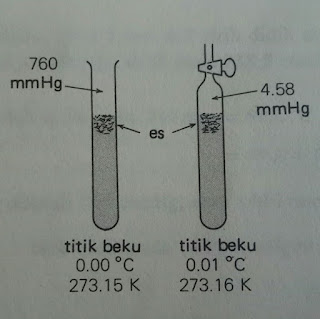
Gambar.
Titik beku air di udara pada 1 atm adalah 0,00°C
dan tekanan uap 4,58 mmHg. (udara diusir dari dalam wadah kanan oleh sebuah
pompa vakum, kemudia keran ditutup dan tabung didinginkan sampai terbentuk
kristal es).














Tidak ada komentar:
Posting Komentar